Pernahkah kalian mencari informasi berbagai jenis unsur?
Saat ini terdapat lebih dari 100 unsur teridentifikasi. Awal mulanya mempelajari unsur-unsur cukup mudah dengan hanya menuliskan daftar unsur seperti biasanya kita menuliskan daftar belanja karena pada waktu itu jumlah unsur yang ditemukan masih sedikit.
Semakin banyak penemuan dilakukan, semakin sulit menghafalkan dan mempelajari unsur-unsur tersebut.
Maka beberapa ilmuwan terus-menerus mencoba menggolongkan unsur-unsur tersebut menurut suatu sifat tertentu sehingga lebih mudah dipelajari hingga disepakati sistem penggolongannya yang sering kita liat sebagai tabel periodik unsur.
Seperti apa penggolongan unsur-unsur tersebut? Mari kita bahas lebih lanjut.
Daftar Isi:
Pengertian Tabel Periodik Unsur
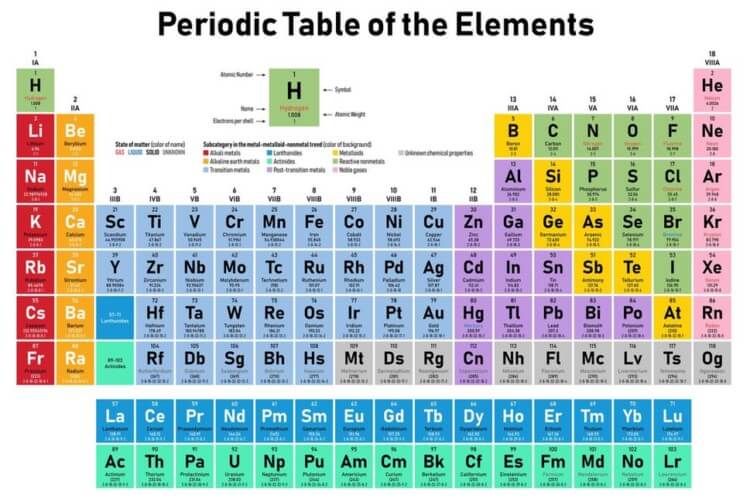
Baris (letak horizontal) disebut sebagai periode, sedangkan kolom (letak vertikal) disebut sebagai golongan. Unsur pada satu periode memiliki jumlah kulit yang sama, sedangkan unsur pada satu golongan memiliki elektron valensi yang sama dan kemiripan sifat.
Penomoran periode yaitu dari atas ke bawah yaitu 1 sampai dengan 7. Penomoran golongan dari kiri ke kanan yaitu dari 1 sampai dengan 18. Setiap golongan memiliki namanya juga.
Namun golongan sering juga menggunakan penomoran A dan B seperti tabel berikut ini:
| Sitem penomoran golongan menggunakan angka numerik | Sitem penomoran golongan menggunakan angka romawi | Nama Trivial Golongan |
| 1 | I A | Alkali |
| 2 | II A | Alkali Tanah |
| 3 | III B | |
| 4 | IV B | |
| 5 | V B | |
| 6 | VI B | |
| 7 | VII B | |
| 8 | VIII B | |
| 9 | VIII B | |
| 10 | VIII B | |
| 11 | I B | Logam Koin |
| 12 | II B | Logam Volatil |
| 13 | III A | Ikosagen |
| 14 | IV A | Kristalogen |
| 15 | V A | Pnictogen |
| 16 | VI A | Kalsogen |
| 17 | VII A | Halogen |
| 18 | VIII A | Gas Mulia |
Pada saat ini terdapat 7 periode dan 18 golongan. Penomoran numerik merupakan model penomoran golongan terbaru menurut IUPAC.
Sedangkan penomoran menggunakan angka romawi merupakan penomoran IUPAC lama, dimana golongan B disebut sebagai unsur transisi.
Nama trivial digunakan untuk setiap golongan yang memiliki karakteristik yang sangat mirip. Nama trivial disebut pula sebagai nama dagang.
Berdasarkan konfigurasinya, tabel periodik unsur tersusun menjadi empat blok, yaitu blok s, p, d, dan f. Susunan tersebut berdasar pada elektron terakhir yang menempati sub-kulit.
Berdasarkan ini terdapat empat blok, yaitu golongan 1 dan 2 merupakan blok s, golongan 3-12 (golongan B) merupakan blok d, golongan 11-18 merupakan blok p, dan yang spesial yaitu golongan f yaitu aktinida dan laktanida.
Golongan f ditempatkan pada tabel spesial di bawah tabel utama. Dalam golongan tersebut kesamaan sifat tidak berdasarkan golongan, melainkan berdasarkan periode.
Tabel periodik unsur modern yang kita kenali merupakan sistem periodik unsur yang diperbarui berkali-kali.
Bagaimana proses pengelompokan unsur-unsur itu hingga menjadi tabel periodik unsur yang kita temui sekarang?
Mari kita bahas lebih lanjut.
Sistem Periodik Unsur
Pengelompokan unsur telah dilakukan oleh para ahli zaman dulu. Penggolongan paling sederhana adalah membagi unsur menjadi dua jenis, yaitu logam & non logam.
Seiring berkembangnya ilmu pengetahuan, para ahli mengelompokkan unsur atas dasar yang berbeda, namun tujuannya adalah sama yaitu agar mudah mempelajari sifat unsur.
Berikut merupakan perkembangan sistem periodik unsur.
- Johan Wolfgang Dobereiner (1829) – Triade Dobereiner
Johan Wolfgang Dobereiner membagi unsur-unsur berdasarkan kemiripan sifatnya. Setiap kelompok terdiri atas 3 unsur, yang dikenal dengan sebutan triad.
Jika unsur-unsur pada 1 triad disusun berdasarkan kenaikan massa atom relatifnya, maka massa atom & sifat unsur yang kedua adalah rata-rata dari massa atom relatif maupun sifat unsur pertama & ketiga.
Contohnya yaitu Klorin (Ar=35,5) dan Iodin (Ar=127) memiliki rata-rata 81,2 yang mendekati Bromin (Ar=79,9), maka ketiga unsur tersebut adalah triade.
Sistem triad inipun ternyata ada kelemahannya. Kelemahan sistem ini adalah adanya unsur-unsur yang tidak tergolong ke dalam 1 triad, namun memiliki beberapa sifat mirip dengan triad tersebut.
- A. R. Newlands (1864) – Oktaf Newlands
Newlands menyusun unsur menurut kenaikan massa atom relatifnya. Unsur yang berselisih 1 oktaf (unsur ke 1 & ke 8, unsur ke 2 & ke 9), memiliki sifat yang mirip.
Hukum oktaf inipun tidak lepas dari kelemahan, yaitu cuma berlaku pada unsur-unsur ringan. Apabila dilanjutkan, kemiripan pada sifat terlalu dipaksakan.
Misal, Zn memiliki sifat berbeda dengan Mg, Be, dan Ca. Berikut tabel periodik oktaf Newlands.
- Dmitri Ivanovich Mendeleev (1869)
Mendeleev mengamati 63 unsur yang sudah ada saat itu, lalu menyimpulkan sifat-sifat unsur merupakan fungsi periodik dari massa atom relatifnya & kesamaan sifat.
Apabila unsur-unsur disusun berdasarkan kenaikan massa atom relatifnya, maka ada sifat tertentu yang berulang secara periodik.
Mendeleev mengelompokkan unsur-unsur yang memiliki sifat yang mirip ke dalam 1 lajur vertikal, yang dikenal sebagai golongan.
Sedangkan untuk lajur horizontal, yaitu lajur unsur menurut kenaikan massa atom relatifnya, dikenal sebagai periode.
Sistem periodik ini memiliki keunggulan dan kelemahan. Kelemahannya adalah adanya penempatan unsur-unsur yang tidak sesuai dengan kenaikan massa atom relatifnya, dan ada unsur yang belum dikenal.
Sedangkan keunggulan sistem periodik ini adalah adanya beberapa tempat yang kosong karena Mandeleev yakin bahwa masih ada unsur yang belum dikenal.
- Henry G. Moseley (1914)
Sekitar 45 tahun kemudian (tahun 1914), Henry G. Moseley (1887 – 1915) menemukan urutan unsur pada sistem periodik sesuai dengan kenaikan nomor atom unsur.
Pengelompokkan iodin (Ar=127) dan telurium (Ar=128) tidak sesuai dengan kenaikan massa atom relatif, sesuai dengan kenaikan nomor atomnya (dimana nomor atom Te=52, I=53).
Lebih tepatnya, sifat periodik dikatakan sebagai fungsi nomor atom. Lalu, sistem periodik unsur modern dibuat menurut kenaikan nomor atom dan sifat-sifat yang mirip.
Jadi, Sistem periodik unsur modern adalah hasil dari sistem periodik yang disusun Mendeleev yang disempurnakan.
Sistem periodik Henry G. Moseley yang menurut kenaikan nomor atom ini yang kita gunakan dan dikembangkan untuk unsur-unsur baru hingga saat ini.
Bagaimana cukup panjang bukan sejarah sistem periodik? Bagaimana kalau kita latihan soal dulu? Yuk kerjakan dan perhatikan contoh soal berikut ini.
Contoh Soal
- Perhatikan tabel periodik! Apakah perbedaan hidrogen (H), Lithium (Li), dan Natrium (Na)? Bukankah mereka satu golongan dan memiliki sifat yang mirip?
Pembahasan:
H, Li, dan Na berada pada satu golongan, namun beda periode. H pada periode 1, Li pada periode 2, dan Na pada periode 3. Periode menunjukkan jumlah kulit dari unsur tersebut. Semakin banyak kulit atom maka semakin besar ukuran atom sehingga mempengaruhi berbagai sifat baik fisika maupun kimia.
- Sebutkan 4 nama trivial golongan!
Pembahasan:
Nama-nama trivial golongan unsur yang terkenal yaitu:
Golongan 1 / I A = Alkali
Golongan 2 / II A = Alkali Tanah
Golongan 17 / VII A = Halogen
Golongan 18 / VIII A = Gas Mulia
- Li (Ar=7), Na (Ar=23), dan K (Ar=39) merupakan unsur dalam satu golongan dengan periode yang berjajar dan sifat yang mirip. Apakah ketiga unsur tersebut memenuhi triade Dobereiner?
Pembahasan:
Triade dihitung dari rata-rata dua unsur dengan massa terkecil dan terbesar. Maka, perhitungannya sebagai berikut.
Ar Na = (Ar Li + Ar K)/2
= (7 +39)/2
= 23
Karena hasil pehitungan sama/mendekati, maka ketiga unsur tersebut adalah triade.
- Bagaimana perbedaan tabel periodik Mendeleev dengan tabel periodik modern saat ini?
Pembahasan:
Mendeleev diurutkan berdasarkan kenaikan massa, sedangkan tabel periodik modern diurutkan berdasarkan kenaikan nomor atom.
Referensi: https://rumuspintar.com/